
Актуальные проблемы в машиностроении
. Том 4. № 3. 2017
Инновационные технологии
в машиностроении
____________________________________________________________________
29
условиях.
Анализ поляризационных исследований анодного растворения ARMKO-железа в 10%
водном растворе хлорида натрия указывает на наличие областей его активного и пассивного
растворения [4]. Однако, в указанной работе не устанавливалось влияние концентрации соли
в электролите и его температуры на процесс анодного растворения. По этой причине данная
работа посвящена исследованию влияния концентрации хлорида натрия и температуры
электролита на скорость анодного растворения при помощи потенциодинамического метода.
Методика экспериментального исследования
Экспериментальные исследования проводились в водных растворах хлорида натрия с
концентрацией соли от 10 до 20% и при изменении его температуры от 22 до 40 ̊С для
указанных концентраций. Эксперименты проводились с помощью потенциодинамического
метода, применяемого при исследовании анодного поведения материала в электрохимии,
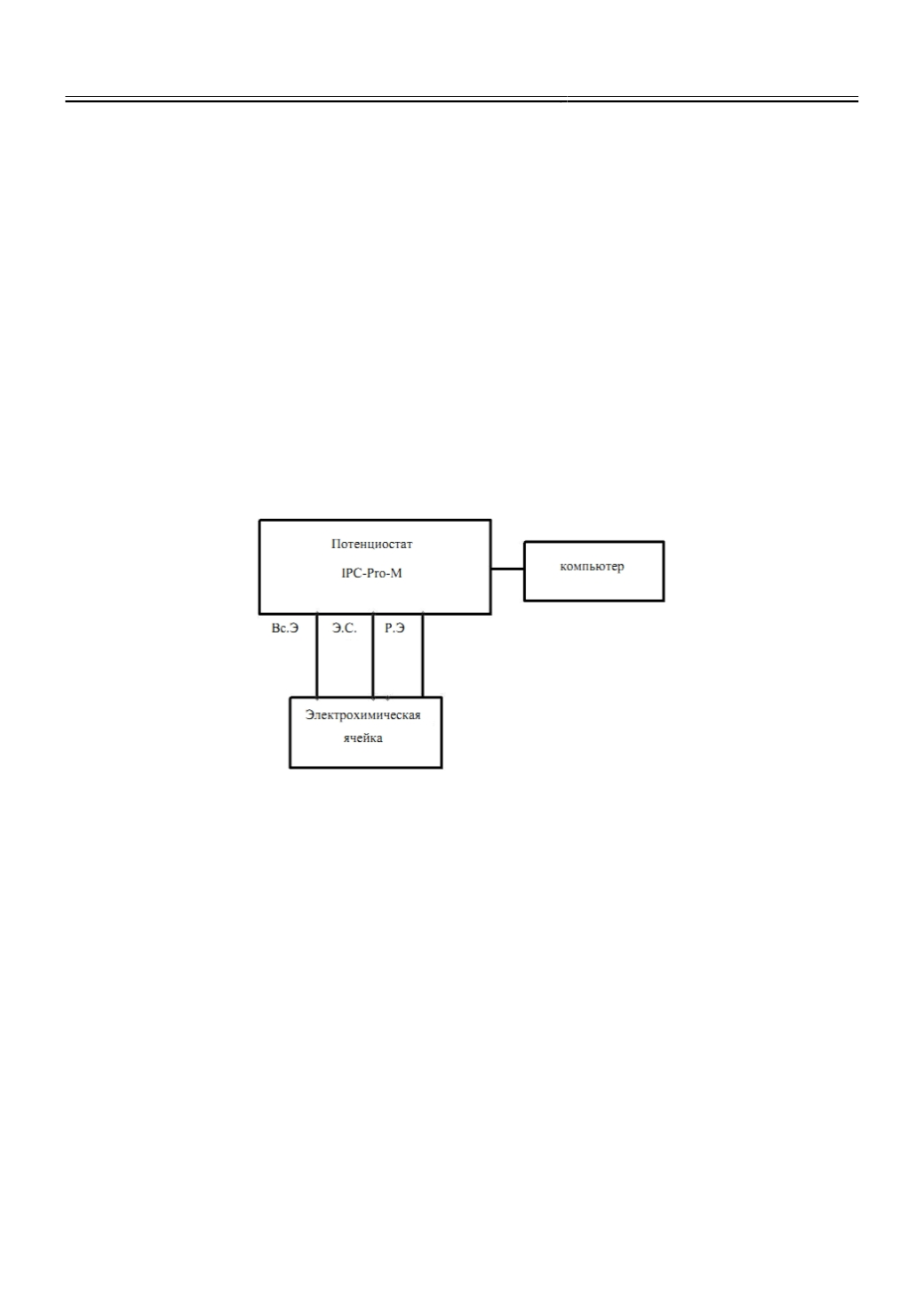
реализуемого при помощи потенциостата IPC Pro M и электрохимической ячейки (рис. 1). В
качестве электрода сравнения использовался платиновый электрод сравнения. Материал
вспомогательного электрода (катода) – медь.
Рис. 1.
Функциональная схема экспериментальной установки для исследования анодного
поведения материала: Вс.Э.- вспомогательный электрод (катод), Э.С. – электрод сравнения,
Р.Э. – рабочий электрод (исследуемый образец – анод)
Результаты и обсуждения
Результаты поляризационных исследований анодного поведения ARMKO – железа в
водном растворе хлорида натрия с концентрацией соли от 10 до 20 % представлены на рис. 2.
Анализ поляризационных кривых указывает на тот факт, что повышение концентрации соли
в составе электролита неоднозначно влияет на достигаемые значения плотности тока, а
следовательно, и на скорость электрохимического растворения. С одной стороны увеличение
концентрации соли с 10 до 20% в области диапазонов от 0 до 2,5 В приводит к некоторому
снижению плотности тока (с максимального значения 30 мА/мм
2
до 25 мА/мм
2
), с другой - в
диапазоне потенциалов свыше 2,5 В до 5 В к незначительному увеличению плотности тока
при повышении концентрации соли с 10 до 15% (с максимального значения 60 мА/мм
2
до 63
мА/мм
2
). При этом характерные участки пассивации и активного растворения не изменяют
своего положения на поляризационной кривой. По этой причине можно утверждать, что
увеличение концентрации соли в составе электролита на оказывает существенного влияния
на скорость и характер анодного растворения ARMKO – железа.
















